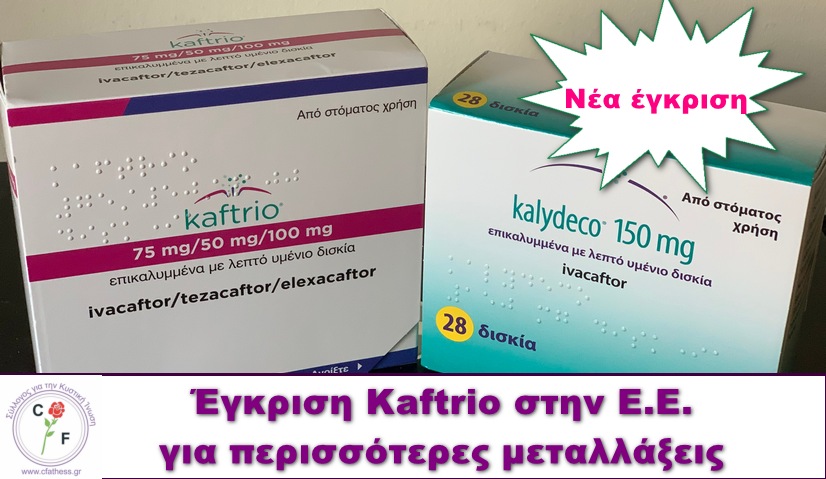
Έγκριση Kaftrio στην Ε.Ε. για περισσότερες μεταλλάξεις
Σας ανακοινώνουμε ότι στις 7 Απριλίου 2025 η εταιρία Vertex Pharmaceuticals ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή ενέκρινε για την επέκταση χορήγησης του KAFTRIO® (ivacaftor/tezacaftor/elexacaftor) σε συνδυασμό με Kalydeco (Ivacaftor) σε ασθενείς με Κυστική Ίνωση ηλικίας 2 ετών και άνω που έχουν τουλάχιστον μία μετάλλαξη μη κατηγορίας Ι στο υπεύθυνο για την Κυστική Ίνωση (CFTR) γονίδιο. (Οι μεταλλάξεις κατηγορίας Ι είναι αυτές στις οποίες δεν παράγεται πρωτεΐνη CFTR από το ελαττωματικό γονίδιο). (Ασθενείς με δύο μεταλλάξεις κατηγορίας Ι που δεν παράγουν την πρωτεΐνη CFTR δεν είναι επιλέξιμοι για θεραπείες με ρυθμιστές πρωτείνης CFTR).
Η απόφαση αυτή στηρίχθηκε σε προηγούμενη θετική γνώμη της αρμόδιας επιτροπής η οποία αξιολόγησε δεδομένα αποτελεσματικότητας και ασφάλειας από κλινικές και εργαστηριακές μελέτες, συμπεριλαμβανομένης μιας τυχαιοποιημένης ελεγχόμενης με εικονικό φάρμακο δοκιμής, μιας ανοιχτής μελέτης, καθώς και δεδομένα από μια πραγματική μελέτη αποδεικτικών στοιχείων που διεξήχθη από το Αμερικάνικο Ίδρυμα Κυστικής Ίνωσης καθώς και βιβλιογραφικά δεδομένα που ελήφθησαν μέσω ενός προγράμματος παρηγορητικής χρήσης της Γαλλίας.
Με την έγκριση αυτή, για πρώτη φορά περίπου 4.000 άτομα που ζουν με Κυστική Ίνωση στην Ευρωπαϊκή Ένωση είναι πλέον επιλέξιμοι για ένα φάρμακο που αντιμετωπίζει την υποκείμενη αιτία της νόσου τους.